水溶液 の 計算 303321-水溶液の計算問題
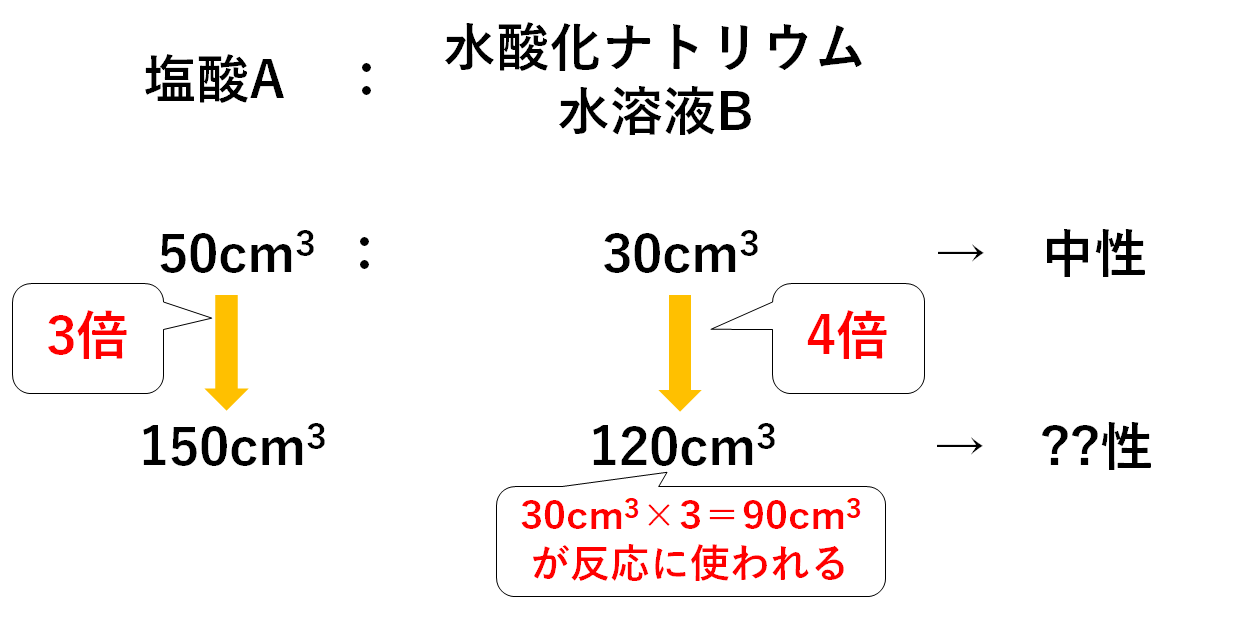
このように、10×1013 というきわめて小さい濃度にはなりますが、酸の中にも微量のOH - が存在しているということはちょっと不思議に思えます。 (例2) 001mol/Lの水酸化ナトリウムNaOH溶液のpHはいくらになるかを考えてみましょう。 水酸化ナトリウムNaOHは、水に溶けて次のように電離し
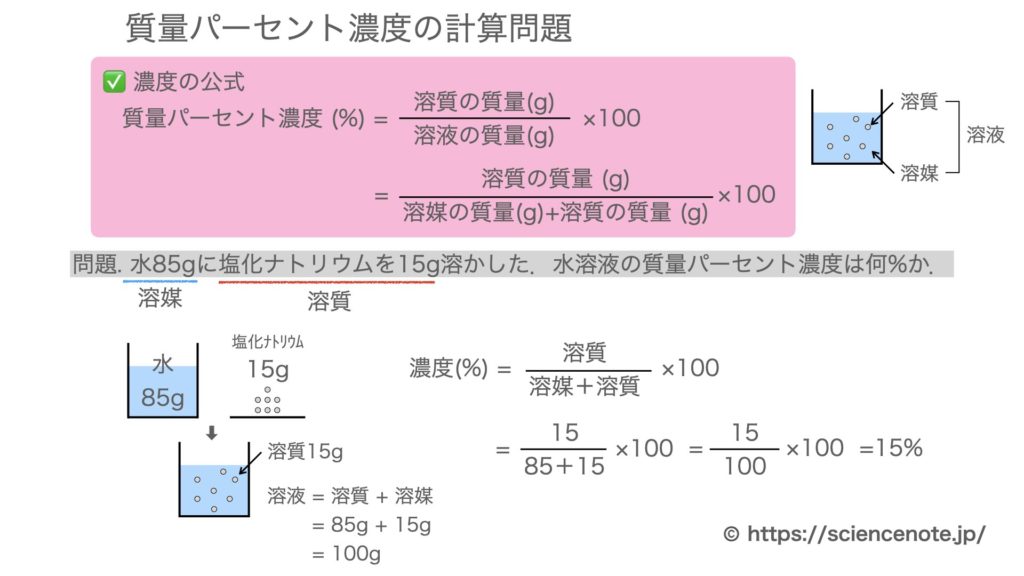
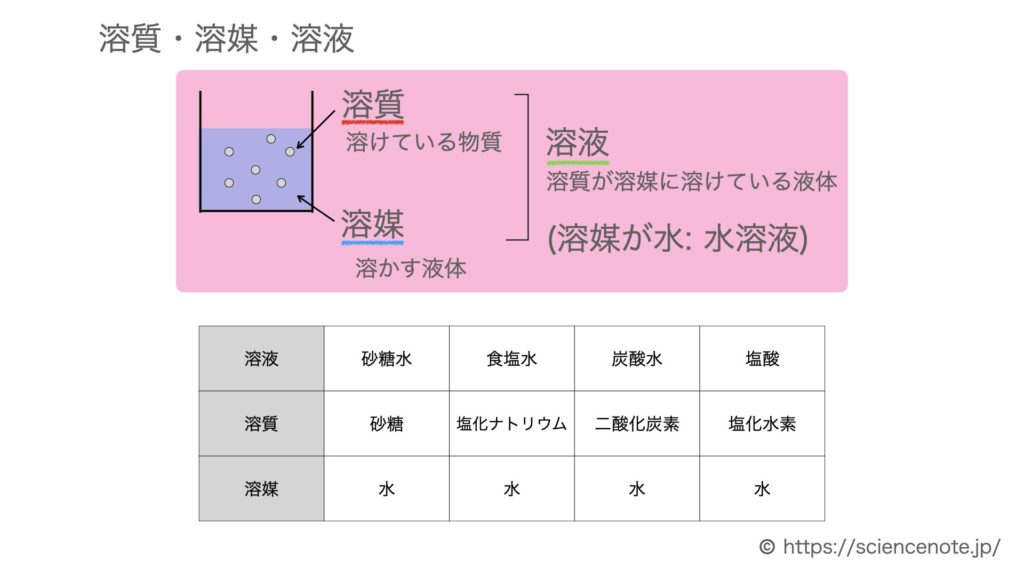
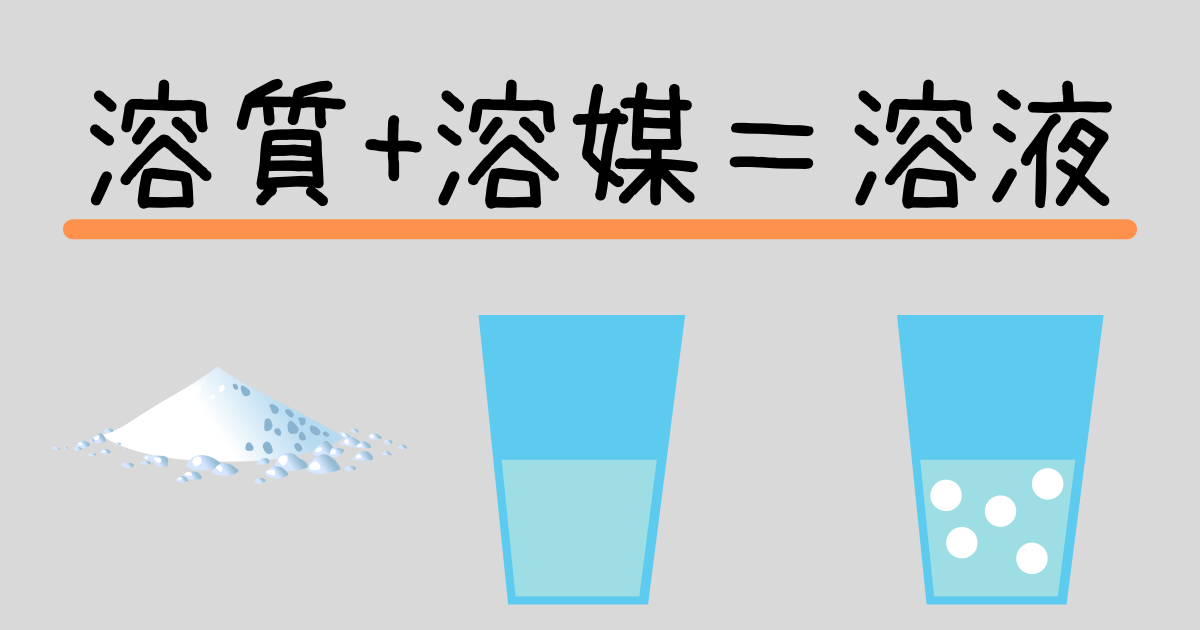
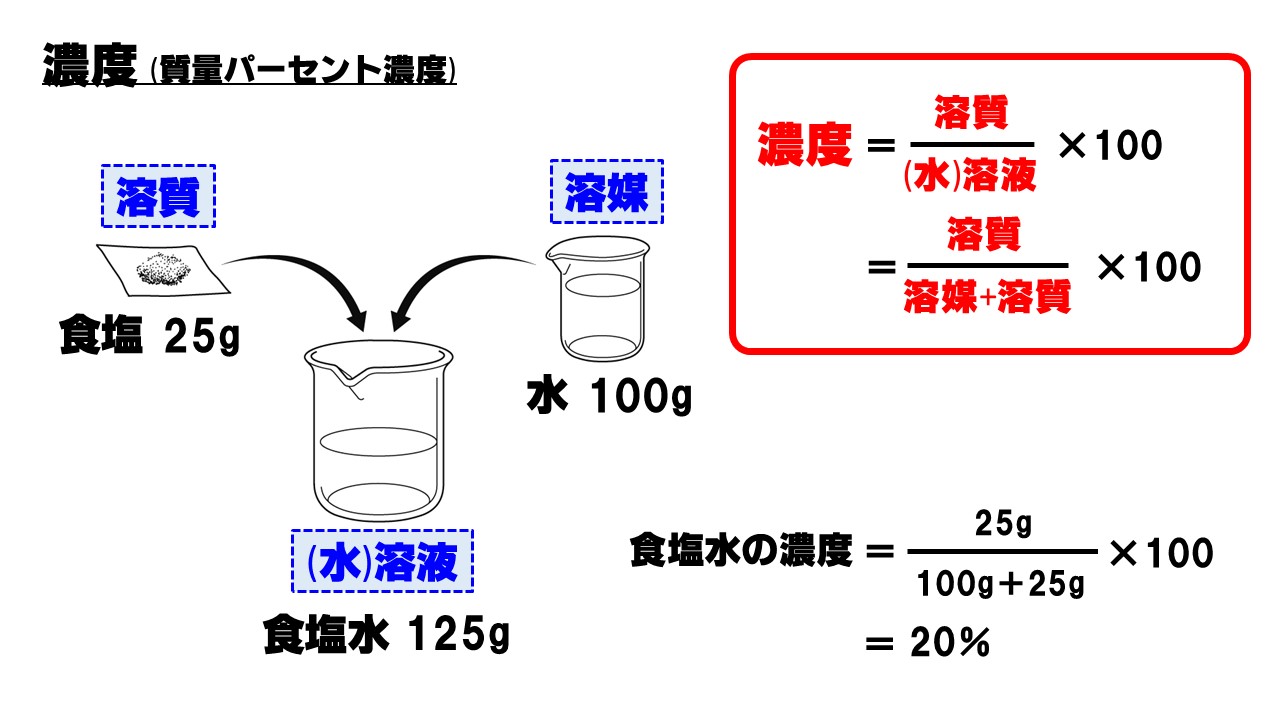
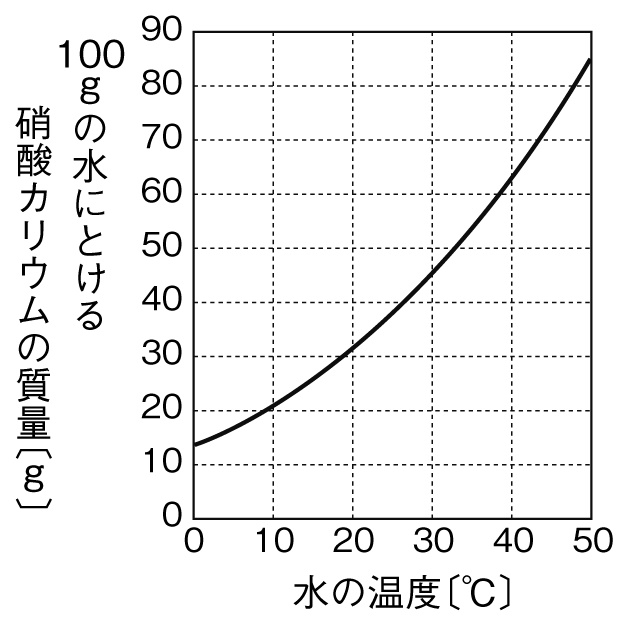
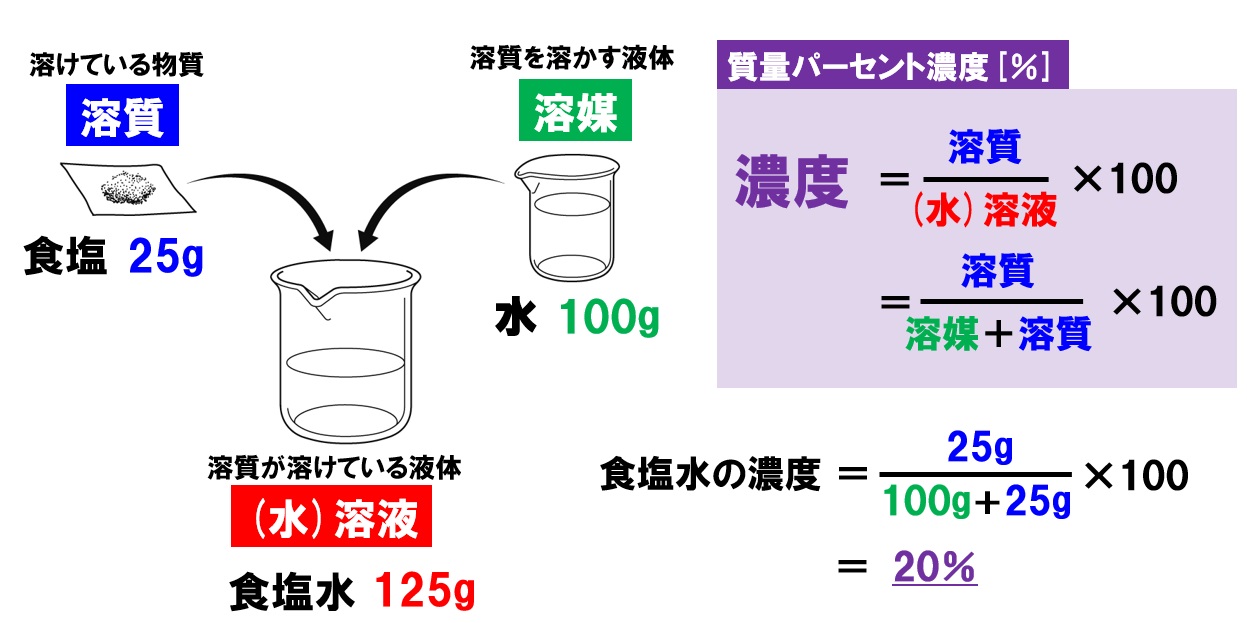
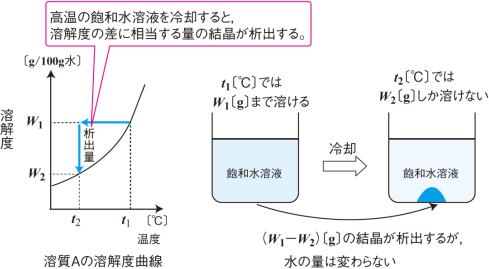
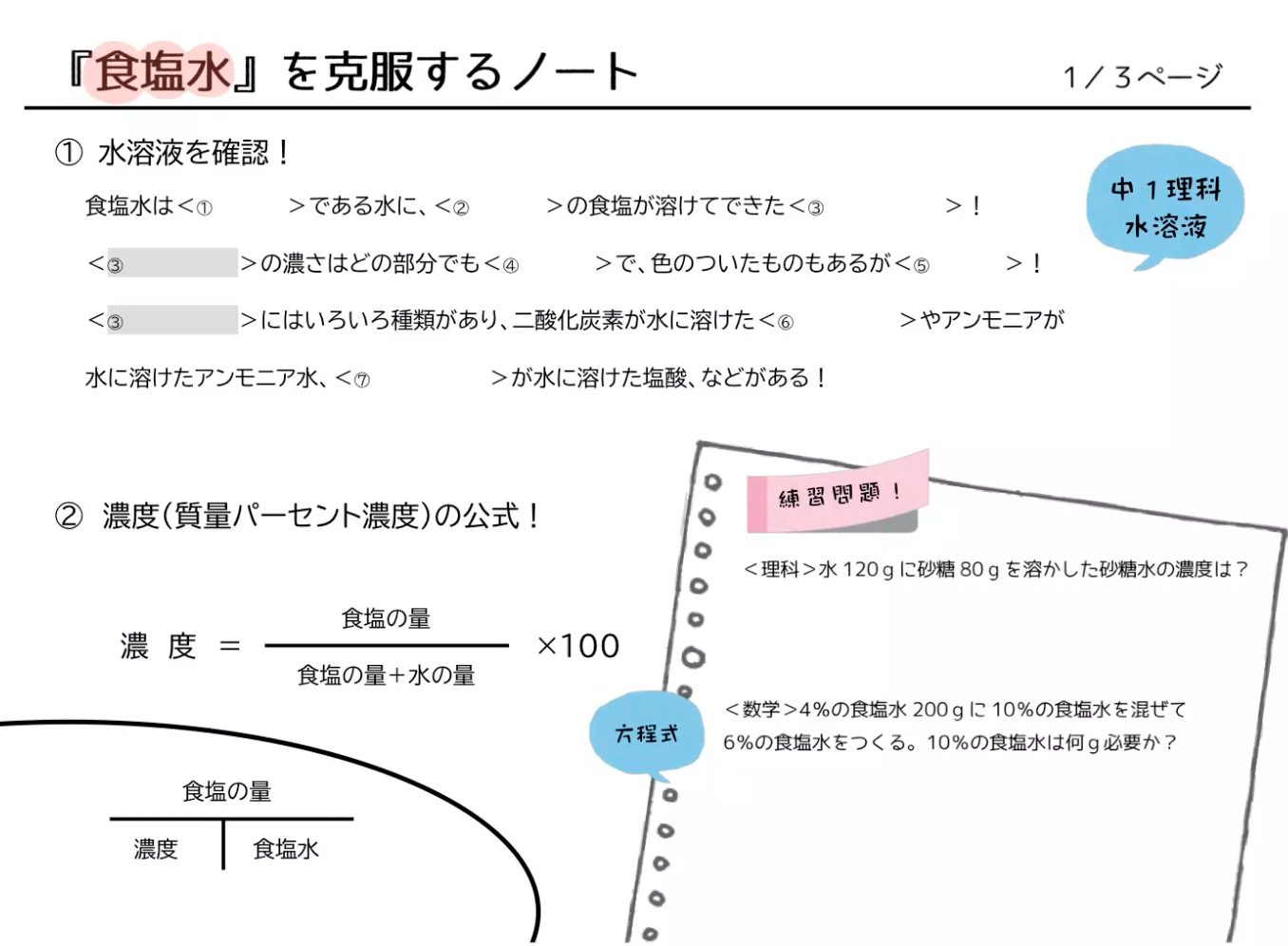
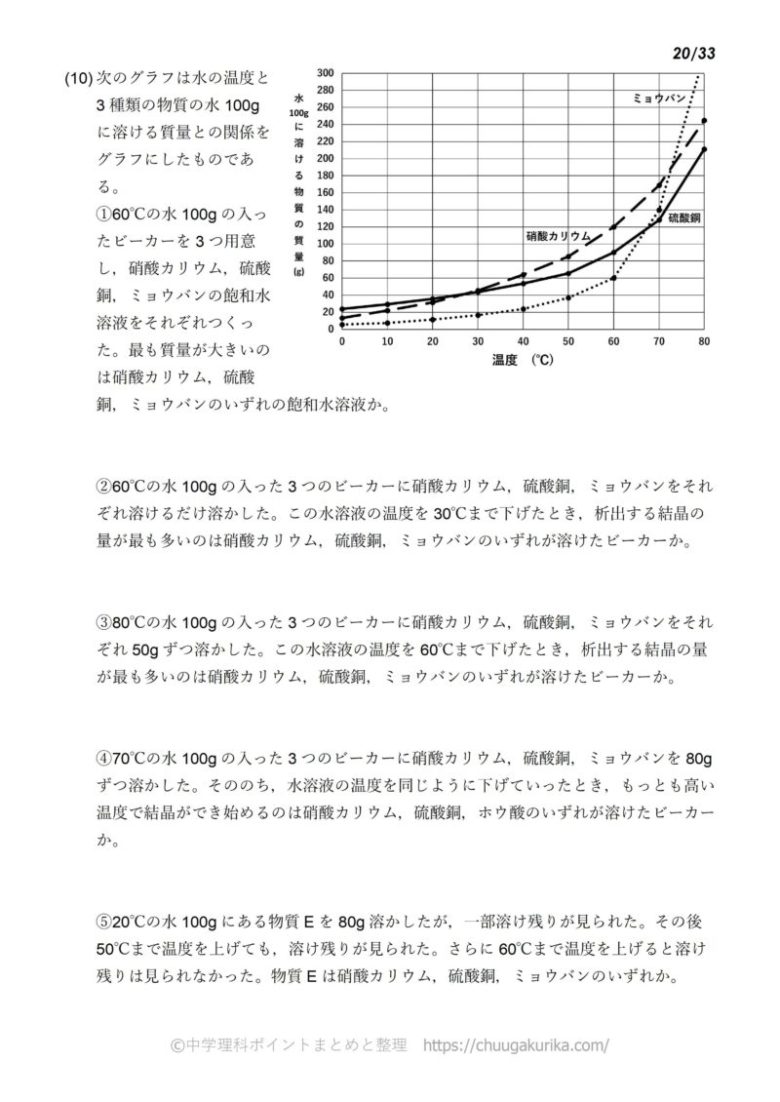
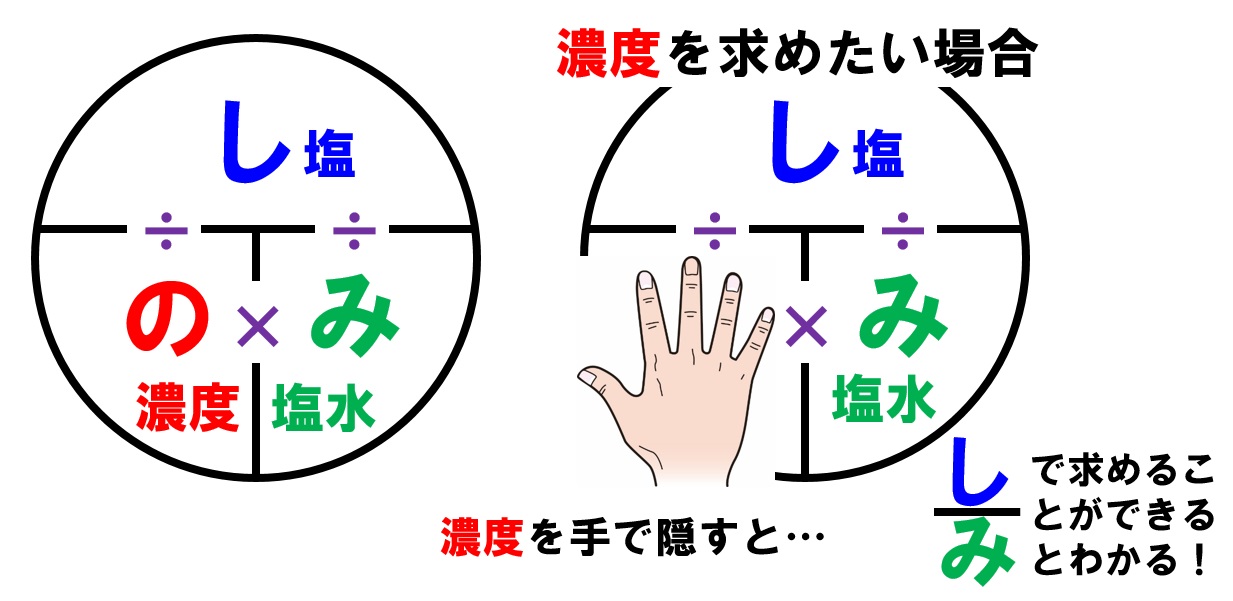
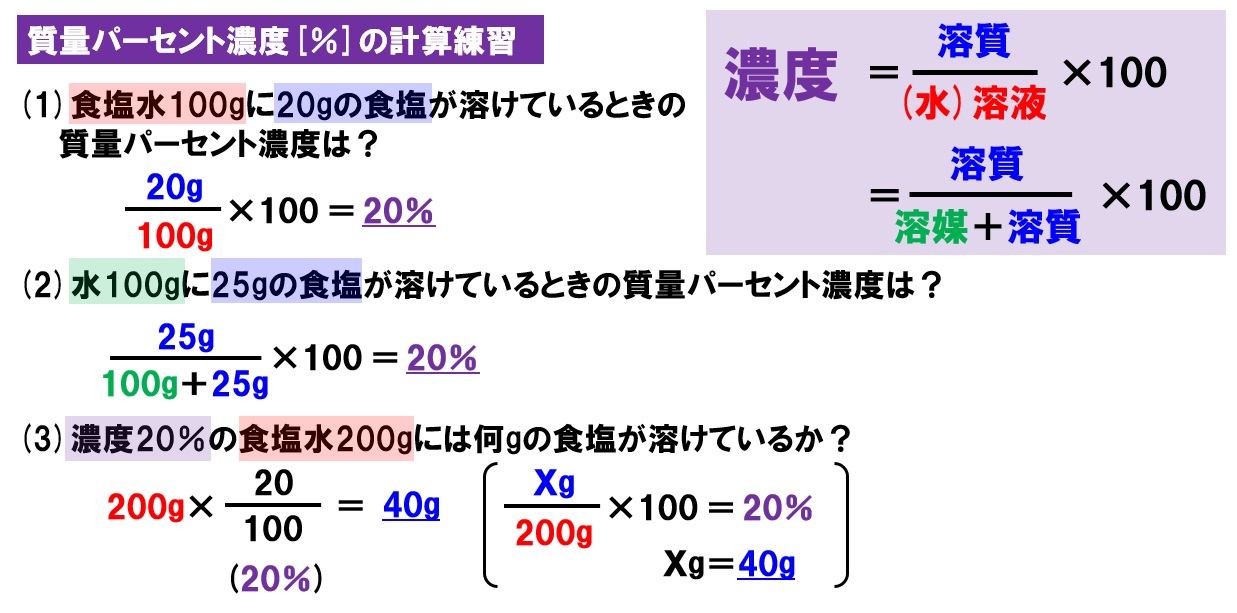
水溶液の計算問題- 中1 水溶液について 中学生 理科のノート Clearnote 表紙 1 2 公開日時 21年11月26日 22時27分 更新日時 21年11月26日 22時35分 中学生 1年生 理科 右の溶液には溶質がたくさんあるので濃くなります。 このような 濃さを表すのが,質量パーセント濃度 という考え方です. 質量パーセント濃度の公式と計算問題の解き方 水85gに塩化ナトリウムを15g溶かした.水溶液の質量パーセント濃度は何%か
水溶液の計算問題のギャラリー
各画像をクリックすると、ダウンロードまたは拡大表示できます
 |  |  |
 |  |  |
 |  |  |
 |  | |
「水溶液の計算問題」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  |  |
 |  |  |
 |  |  |
「水溶液の計算問題」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  |  |
 |  | |
 |  |  |
「水溶液の計算問題」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  |  |
 |  |  |
 |  | |
「水溶液の計算問題」の画像ギャラリー、詳細は各画像をクリックしてください。
 | 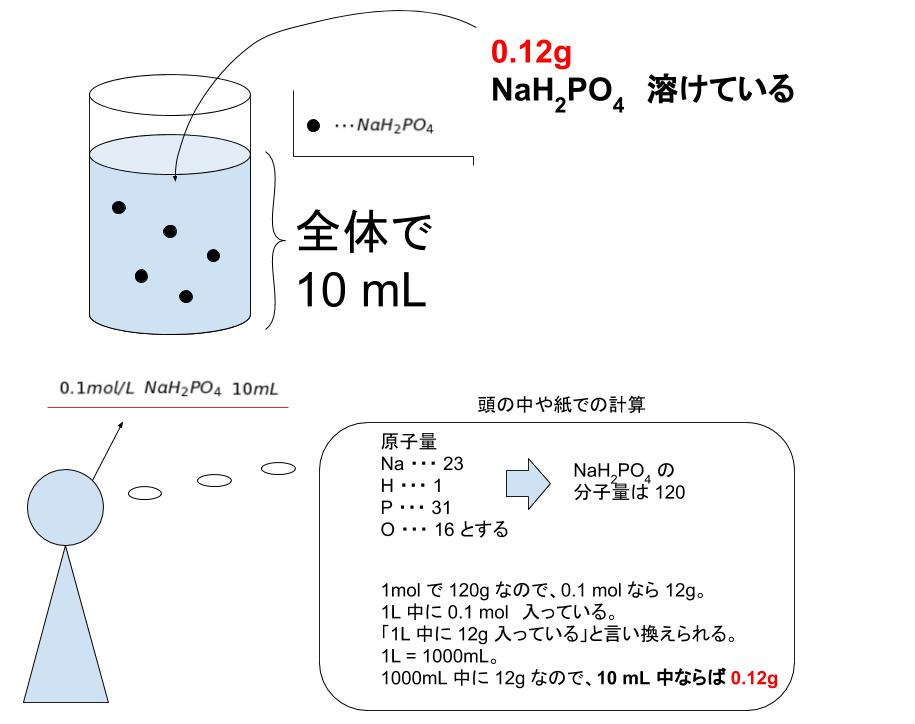 |  |
 |  | |
 | 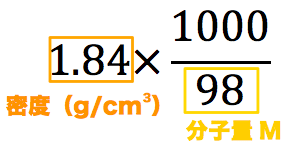 |  |
 |  |  |
「水溶液の計算問題」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  |  |
 |  |  |
 |  |  |
「水溶液の計算問題」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  |  |
 |  |  |
 |  |  |
「水溶液の計算問題」の画像ギャラリー、詳細は各画像をクリックしてください。
 | ||
 |  |  |
 |  | |
 |  | |
「水溶液の計算問題」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  | |
 |
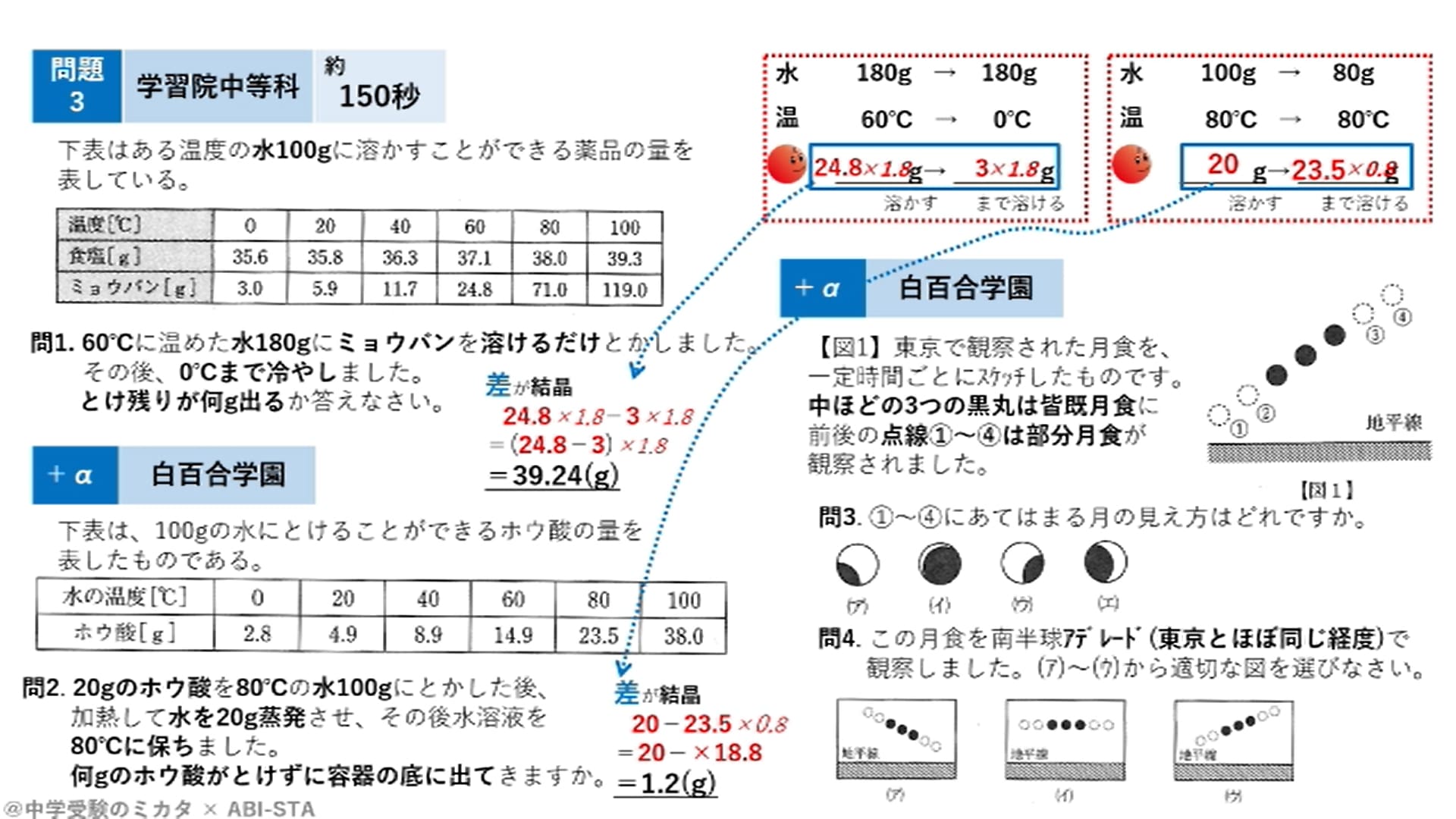
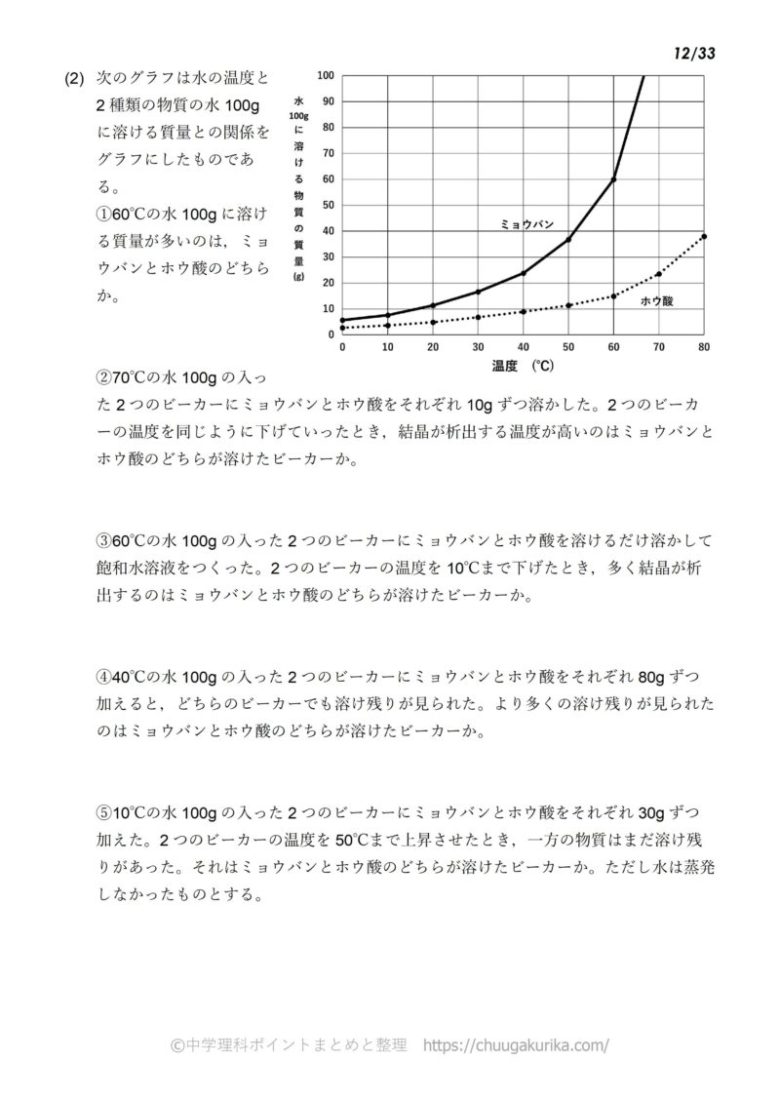
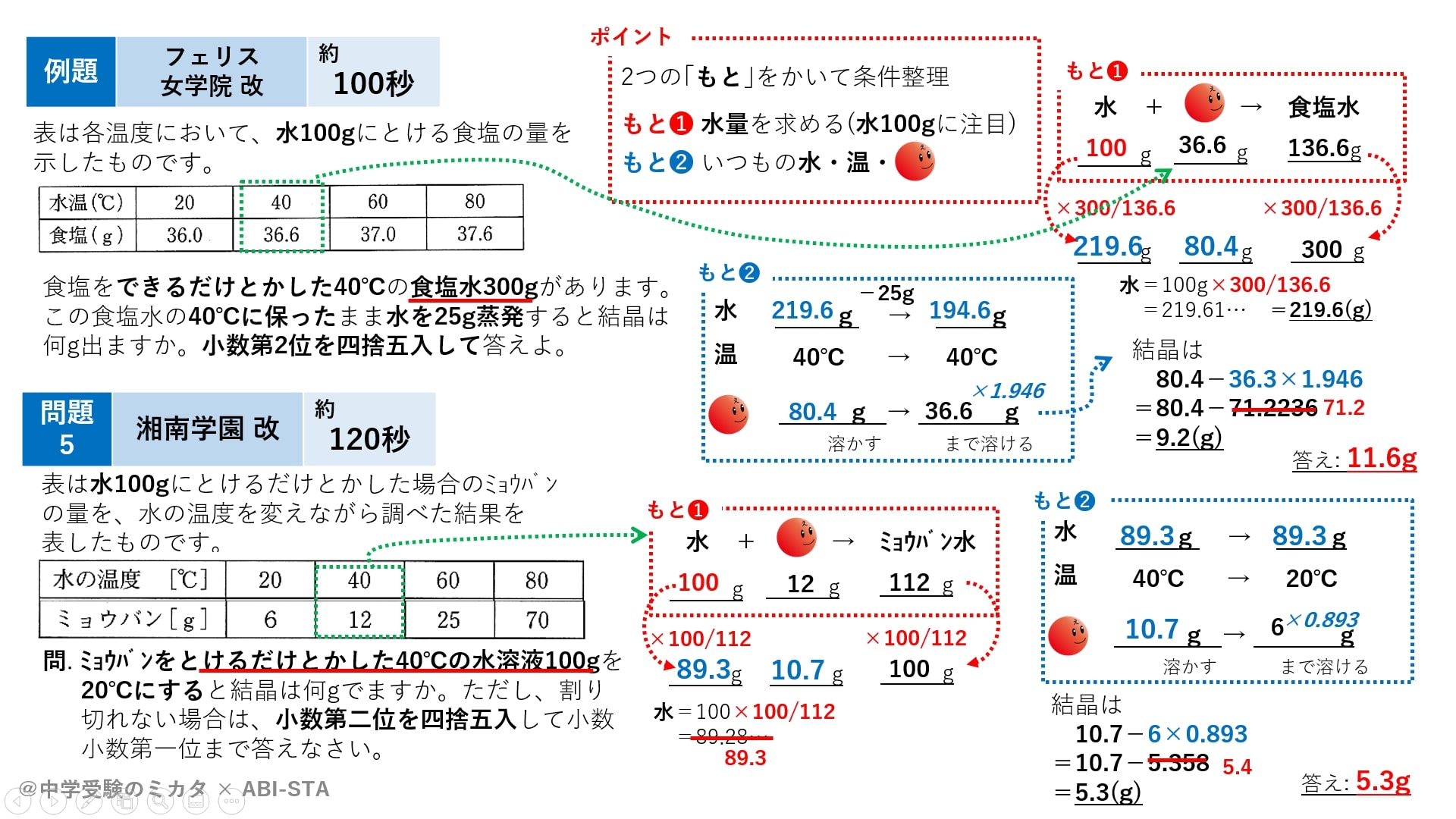
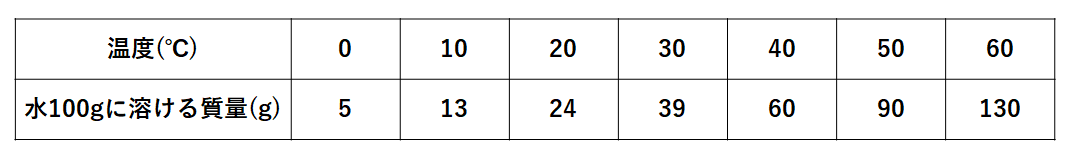
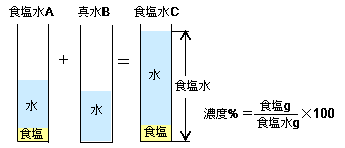
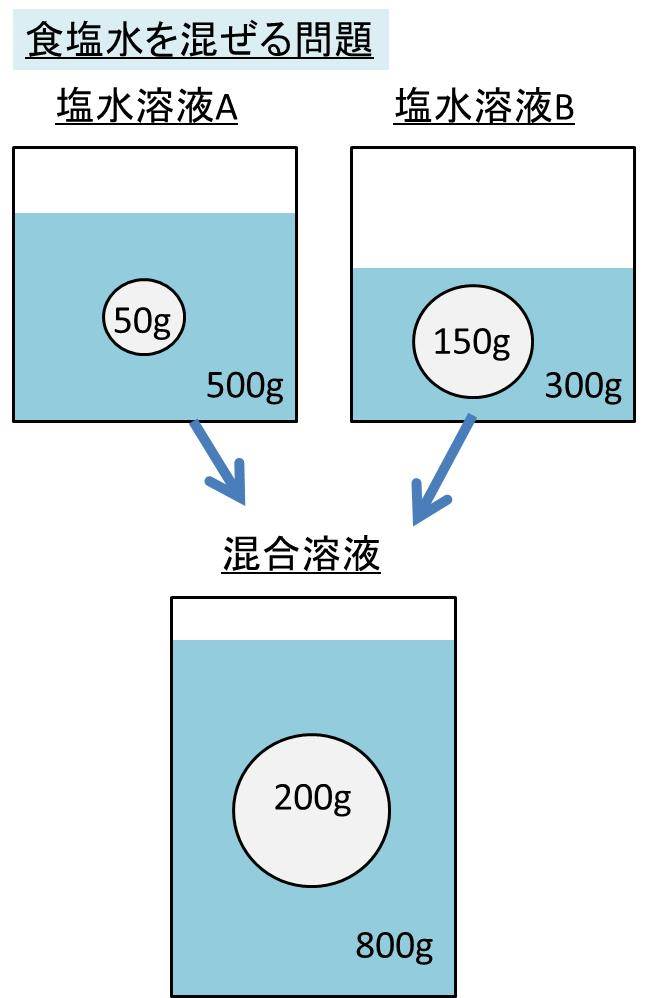
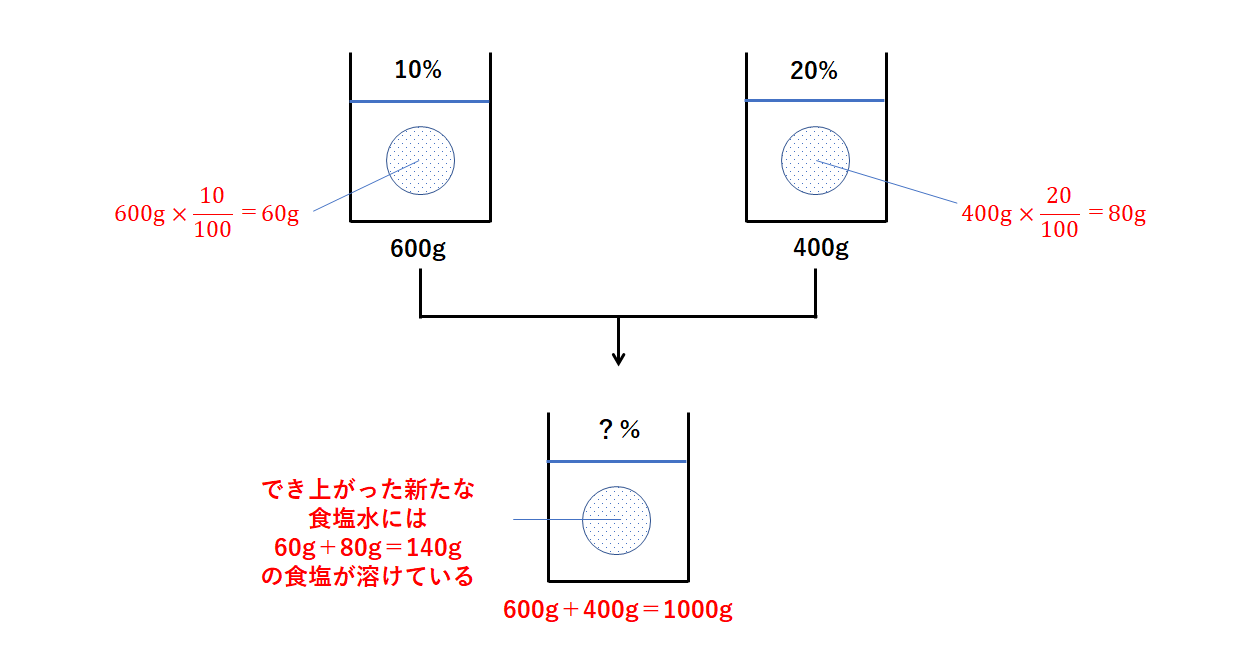
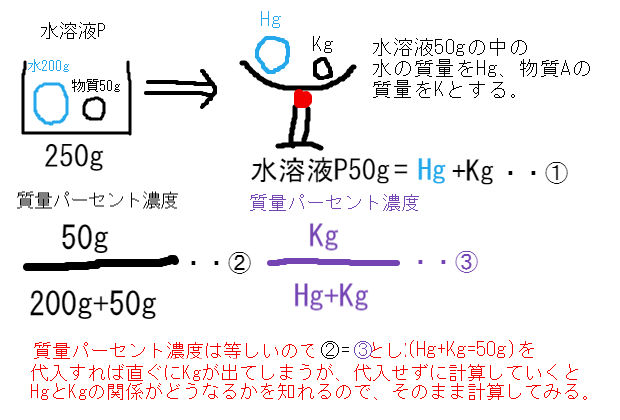
解答:1溶質2溶媒 凝固点降下の公式 ΔT f = K f ・m ΔT f :凝固点降下度 K f :モル凝固点降下(定数:溶媒に固有)(K・kg/mol) m:質量モル濃度(mol/kg) P o int! 1g(食塩の水溶液の質量)=g(食塩の質量)+100g(水の質量) 基本的な計算問題の解き方 次のような問題が基本問題として出題されます 水114gに食塩を6gとかしたとき、何%の食塩水が何gできるか 食塩水の質量=114+6=1 濃度=6÷1×100=50
Incoming Term: 水溶液の計算, 水溶液の計算問題, 水溶液の計算 中学受験,
コメント
コメントを投稿